近日,我校水产学院刘静霞教授领衔的鱼类逆境发育生物学团队联合信息学院方亚平副教授和李国亮教授在国际学术期刊 Advanced Science 发表了题为“Nap1L4a Cooperates with Scl/Klf1 to Recruit H2A.Z in Mediating Interactions Among Cis-Regulatory Elements and Transcription Required for Primitive Erythropoiesis in Zebrafish”的研究论文。该研究通过整合斑马鱼突变体表型分析与CUT&Tag、ATAC-Seq及RNA-Seq等大规模多组学数据,从表观遗传修饰与转录调控互作的角度,系统解析了核小体组装蛋白Nap1L4a在红细胞发育中的功能网络,构建并阐述了“Nap1L4a-Scl/Klf1-H2A.Z”这一全新的表观遗传调控复合物模型,深入揭示了核小体组装蛋白Nap1L4a在重塑染色质景观调控、驱动红系基因表达及响应低氧胁迫中的核心作用,为解析人类血液疾病发病机理及鱼类抗低氧等性状形成的遗传基础提供了全新理论基础。

原始红细胞的生成对于胚胎早期的氧气运输和存活至关重要。红细胞的发生是一个受到精密调控的复杂过程,涉及多重转录因子网络与表观遗传修饰的协同作用。尽管目前已知Scl、Lmo2等转录因子在造血中扮演核心角色,但在细胞核内的微观世界中DNA是被紧密缠绕在核小体上,这些转录因子如何克服物理障碍、精准识别并开启红细胞基因转录,长期以来是未解之谜。为此,研究团队利用模式生物斑马鱼,系统开展了染色质重塑因子在早期造血中的功能筛选与机制研究。Nap1L4a 是一个在红系祖细胞中高表达、在进化上高度保守,且与人类白血病密切相关的关键因子。通过构建及分析 nap1l4a 基因敲除斑马鱼突变体,团队发现nap1L4a突变体胚胎中红细胞数量显著减少,出现严重的贫血表型,且表现出对低氧环境的高度敏感性(图1)。
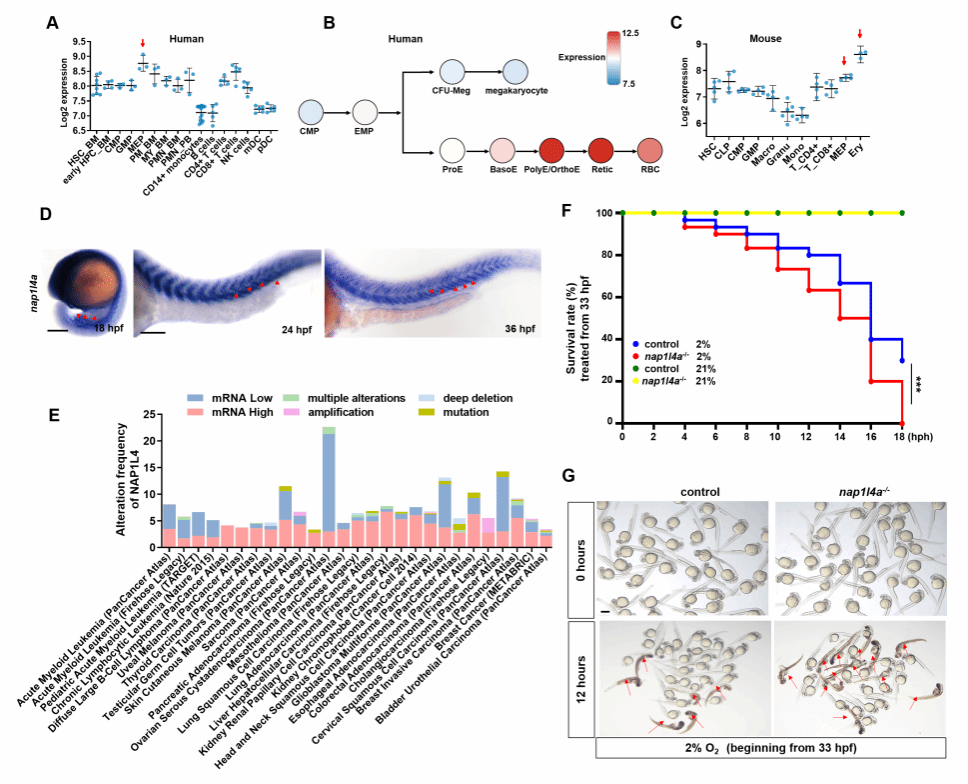
图1 Nap1L4a缺失导致斑马鱼原始红细胞生成障碍及低氧敏感性
为深入揭示Nap1L4a调控红细胞生成的分子机制,研究团队结合CUT&Tag、ATAC-Seq及RNA-Seq等多组学技术,绘制了Nap1L4a介导的表观遗传调控网络。研究发现,Nap1L4a并非“单打独斗”,而是作为一个分子支架,与红系特异性因子Klf1和Scl发生直接的物理相互作用。这一复合物(Nap1L4a-Scl-Klf1)能够特异性地结合到红系关键基因的顺式调控元件(Cis-Regulatory Elements, CREs)上。更为关键的是,Nap1L4a在此过程中发挥了其作为组蛋白伴侣的功能,它负责招募组蛋白变体H2A.Z整合入核小体。H2A.Z的引入显著降低了核小体的稳定性,使染色质结构变得松散开放,从而促进了增强子与启动子之间的相互作用,激活了下游造血关键基因的转录表达。此外,该研究还发现Nap1L4a能够正向调节WNT/β-Catenin信号通路,形成了一个多维度的调控网络(图2)。
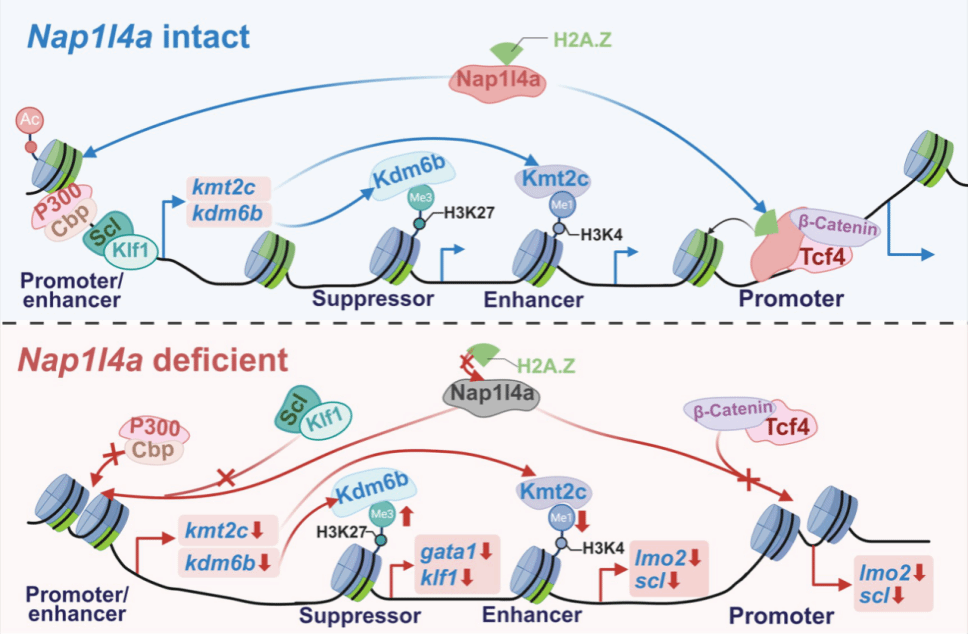
图2 Nap1l4a调控斑马鱼红细胞生成的作用机制
该研究首次构建了“Nap1L4a-Scl/Klf1-H2A.Z”这一表观遗传调控轴,系统阐明了染色质重塑因子如何精准配合转录因子,通过改变染色质构象来驱动特定原始红细胞谱系发生机制。这一发现不仅丰富了对脊椎动物造血发育调控网络的理论认识,也为人类先天性贫血、地中海贫血等红细胞相关疾病的诊断提供了重要的理论依据和潜在线索。同时,本研究也丰富了鱼类抗低氧等抗逆性状形成的遗传基础的理论与实践。
开云电竞游戏水产学院刘静霞教授和信息学院方亚平副教授为该论文的通讯作者,水产学院博士生石佳豪、信息学院已毕业硕士生赖福明和水产学院已毕业硕士生沈铮为共同第一作者,信息学院李国亮教授和南京大学医学院李宽钰教授提供了重要指导,研究生张小燕、王翰飞、已毕业博士生王云龙和已出站博士后刘文叶也参与了该研究。
美国哈佛大学医学院Leonard I. Zon教授(美国三院院士),清华大学的孟安明院士,华南理工大学的张译月教授,上海交通大学的经莉莉教授,上海中医药大学的蔡舒阳博士和浙江大学的帖儒修博士在课题的研究过程中给予很多帮助。本研究中的一些斑马鱼品系从国家斑马鱼资源中心获取。本研究得到国家重点研发计划项目(2022YFF1000302)、国家自然科学基金项目(32500719和32570762)、国家生物育种重大科技项目(2023ZD04065)、中央高校基本科研业务费项目, 及湖北省重点研发计划项目等资助。
该学科组一直围绕斑马鱼造血系统的发育遗传学开展研究。本论文是继该学科组研究成果The FASEB Journal(Jing et al., 2025; Li et al., 2022),iScience (Li et al., 2023; Liu et al., 2024), Development(Liu et al., 2024),Cell Communication and Signaling (Jing et al., 2024),Angiogenesis(Tai et al., 2022)等后的又一重要发现。
英文摘要:
The chromatin remodeler nucleosome assembly protein 1-like 4 (Nap1L4) is highly expressed in megakaryocyte-erythroid progenitors (MEPs) and erythroid cells. Mutations, deletions, and aberrant expressions of Nap1L4 are observed in diseases such as acute myeloid leukemia (AML). However, the roles of Nap1l4a in erythropoiesis and related diseases, as well as the underlying mechanisms, remain unknown. Here, it is demonstrated that zebrafish nap1l4a homozygous mutants (nap1l4a-/-) are more sensitive to hypoxia stress during the early embryonic stage and exhibit impaired primitive erythropoiesis. Mechanistically, zebrafish Nap1l4a interacts with the erythropoietic transcription factors (TFs) Scl and Klf1, and recruits the histone variant H2A.Z. This interaction remodels the cis-regulatory element (CRE) landscape and promotes nascent RNA transcription of erythropoietic genes. Meanwhile, Nap1l4a deficiency impairs chromatin accessibility at the epigenetic regulators kdm6b and kmt2c. This results in expanded H3K27me3 and diminished H3K4me1 in erythrocytes, leading to altered histone landscapes at erythropoiesis TF loci and reduced TF expression. Moreover, Nap1l4a regulates primitive erythropoiesis by transcriptionally and epigenetically modulating the canonical WNT/β-Catenin pathway. Together, the findings reveal a lineage-selective transcription, with histone epigenomics-dependent role for nap1l4a in vertebrate primitive erythropoiesis. These findings highlight potential mechanisms underlying human blood disorders and hypoxia responses associated with Nap1l4a deficiency.
论文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202513762
审核:刘静霞